CONTENTS
開発への道
病理組織の診断技術を変える高輝度材料の開発プロジェクトの突破口
有機蛍光色素の集積により高輝度化開発のいま、そして未来
組織染色サービスを事業化開発者の横顔
研究開発に夢や希望は抱かない。ただ、現実を直視するのみ概要
INTRODUCTION
日本では高齢化・生活習慣の変化に伴ってがんによる患者数・死者数が増加傾向にあり、現在、がんは日本人の死因の第1位となっています。NEDOは、がんによる死亡者数低減と患者のQOL向上につながる早期診断治療技術の開発・普及を目指して、NEDOプロジェクト「がん超早期診断・治療機器の総合研究開発」(2010~2014年度)を実施しました。その中でコニカミノルタ株式会社は、がんの進行度の確定診断や、治療薬の選択の精度を高めることを目的に、東北大学との共同研究により、現在、同社が「QuanticellⓇ」の名称で提供している組織染色サービスの基盤技術を開発しました。本プロジェクトで開発された「高輝度蛍光ナノ粒子/PID(Phosphor Integrated Dots)」は、組織切片中の病気などの指標分子を、高精度かつ定量的に検出することができる組織染色用の粒子で、従来の蛍光組織染色技術が抱えていた、検出色素の輝度や感度、定量性が低い、退色するといった課題を解決しています。この成果は組織染色サービスとして展開され、診断が困難な病気の早期発見や治療薬開発への貢献が期待されています。
開発への道
BEGINNING
病理組織の診断技術を変える高輝度材料の開発
コニカミノルタ株式会社は、大手写真フイルムメーカーとして知られていたコニカ株式会社と、オートフォーカス一眼レフカメラでトップメーカーになったこともあるミノルタ株式会社が、2003年に経営統合してできた企業です。日本の写真工業界の老舗2社の技術力を背景に統合後に新しく立ち上げたヘルスケア事業でも、デジタルX線画像診断、超音波診断システムといった画像診断技術で、さまざまな疾患の早期診断・発見に貢献してきました。近年は、DNAやタンパク質など、より微細なものを可視化するイメージング技術の開発に力を入れています。
2006年当時、コニカミノルタのヘルスケア部門では、次にどのような分野の研究開発に取り組むかを検討していました。その前年にデジタルX線画像診断用のX線検出器の開発に成功、国内外で高く評価された中、デジタルX線画像診断に続く新事業を生み出すことが求められていました。
当時、コニカミノルタ株式会社 MG開発センター Advanced Materialグループリーダーを務めていた中野寧さん(現:公益財団法人コニカミノルタ科学技術振興財団理事)は、蛍光材料を使ったバイオ分野の画像診断という、新しいヘルスケア事業を立ち上げられないかと考えていました。中野さんは「画像の画質を決めるのに重要なのはシグナル信号値の大きさです。蛍光体の発光量をできるだけ大きくすることはシステム上、大きなメリットがあります」と話します。
「明るければいい、というのは実に単純な発想ですが、X線検出器の開発過程で行き着いた考えです。発光量の大きい材料を開発すれば、バイオ・医療分野で必ず役立つ製品になるはずだと考えました」(中野さん)
そして翌2007年には、実際の医療現場で高輝度ナノ粒子がどのような用途に利用可能かを検討するため、東北大学大学院医学系研究科の大内憲明教授(現:名誉教授)や権田幸祐教授との共同研究も始めました。医療現場では、病理切片内の分子を可視化するために、免疫組織化学法(詳細は「なるほど基礎知識」参照)という手法が診断や治療法の選択のために使われていました。この免疫組織化学法では、主に「DAB染色」という組織染色法が用いられます。
「DAB染色」では、病気の指標となるタンパク質に、抗原抗体反応を介して目印を付けた後、酵素反応で茶色に染色します。病理診断医はその発色の強度や面積などの情報から病状を判断して治療法を決めるのです。しかし、この染色方法では指標タンパク質の量を分析するにも、染色の仕組み上、定量的な情報が得られないという課題がありました。
当時、東北大学とコニカミノルタの間を何度も行き来しながら研究開発を行った、コニカミノルタ株式会社HBH APM事業部 システム開発部 創薬支援グループ グループリーダーの高橋優さんは、「治療方針を決める病理組織の免疫組織化学法では、病気の指標となる物質の量を判断するのに『多い』『中程度』『少ない』といった、定性的な基準が使われていることに驚きました」と話します。
そして中野さん、高橋さんらは、「明るい染色像が得られる高輝度ナノ粒子なら、病気の指標となる物質を定量的に把握することができて、治療方針決定に役立つのでは」と考え、東北大学大学院医学系研究科や東北大学病院の病理診断技術開発の研究メンバーに相談したところ、賛同を得ました。
大きな方向転換とNEDOプロジェクトへの参画
医療現場での応用方法も見つかり、本社からも東北大学からも実用化へ大きな期待が寄せられた一方で、研究を続けても思うような成果はなかなか得られませんでした。研究開発開始から3年目を迎える頃には、コニカミノルタは大きな方向転換を迫られることになりました。
中野さんは、「当時は無機材料で作る蛍光ナノ粒子の『量子ドット』で研究開発を進めていましたが、良い結果は一向に得られませんでした。そこで、有機合成ができる研究メンバーに、何かいい発光材料はないかと相談し、実験を進めたところ、1週間ほどで、有機材料の蛍光ナノ粒子を作ることができたのです」と話します。
このナノ粒子は溶剤に溶けてしまうという大きな問題点がありましたが、約6カ月後には改良が進み、後のNEDOプロジェクトの共同研究者である東北大学病院の病理診断医の渡辺みか准教授(現:東北公済病院 病理診断科部長)も「こんな明るい粒子は見たことがない」と驚くほどまでに性能が向上しました。
そして、十分な資金を獲得し、この材料を病理診断に確実に実用化したいと考えた大内教授、権田教授、渡辺准教授らの提案によって、コニカミノルタは、NEDOプロジェクト「がん超早期診断・治療機器の総合研究開発/超早期高精度診断システムの研究開発:病理画像等認識技術の研究開発」に応募し、採択されました。
高橋さんは、「NEDOプロジェクトへの採択は、研究開発費が確保できたというメリットがあっただけではありませんでした」と話します。「NEDOに認められたことで社内評価の風向きが変わり、研究開発が進めやすくなりました。NEDOの支援が得られなければ、開発は大きく遅れていたことでしょう」(高橋さん)
プロジェクトの突破口
BREAKTHROUGH
有機蛍光色素の集積により高輝度化
こうして2010年度から2014年度に実施されたNEDOプロジェクト「がん超早期診断・治療機器の総合研究開発/超早期高精度診断システムの研究開発:病理画像等認識技術の研究開発」で、「高輝度蛍光ナノ粒子/PID(Phosphor Integrated Dots)」(詳細は「なるほど基礎知識」参照)を用いた、高輝度で定量的、退色し難い、病理組織の蛍光イメージング技術の開発が、コニカミノルタと東北大学の共同研究により進められました。
開発の対象となった「蛍光イメージング技術」は、病気などの指標タンパク質に蛍光の目印(この場合はPID)を付け、指標タンパク質の量や分布を調べるのに使われる技術です。この技術を使った多くの場合、指標タンパク質の量は、光学装置が検出する「蛍光強度値」を基に算出されていました。しかし、この値は光学装置によって変わってしまうため、目標とする「定量性」を実現するには問題がありました。
そこで、権田教授は指標タンパク質の量を、PIDの「蛍光強度値」ではなく「粒子数」の単位で算出する、という方法を発案しました。PIDの粒子数は、光学装置の影響を受けずに算出できるため、絶対量として扱うことができます。この概念は、共通の病理診断基準を作ることにもつながると期待されました。
PIDの粒子数を正確に算出するためには、1粒子の蛍光輝度が非常に高く、なおかつ粒子径が均一なPIDを開発しなければなりませんでした。というのも、蛍光輝度が低いとノイズとなる蛍光(組織由来の自家蛍光)が邪魔をして、指標タンパク質をはっきりと捉えられず、また、粒子径にばらつきがあると、各粒子の蛍光強度にブレが生じ、粒子数の算出が困難になるためです。どのような性質のPIDができるかは、その作り方によるため、緻密な検討を重ねました。
PIDは無機物でできた球形の外殻に、数万分子の有機蛍光色素が高密度に詰まった構造をしています。PIDを作るには、溶液の中でまず、無機物でできた外殻を形成させ、そこに有機蛍光色素を入れ込むように操作します(写真1)。

写真1 クリーンルーム内で行われるPID粒子作製作業(再現イメージ)
最初に試作したPIDは、シリカ(SiO2)で作った外殻の中に、ある有機蛍光色素を集積させました。粒子径は比較的揃っていましたが、輝度も耐光性も十分ではありませんでした。第二世代では、外殻のシリカを変更し、有機蛍光色素も輝度の高いものに変えましたが、今度は粒子径が揃いませんでした。
このように外殻については4種類の材料の組み合わせを変えるとともに、そこに集積させる有機蛍光色素は、数十種類を試しました(写真2)。さらに反応温度や試料の添加タイミングもPIDの性能を左右するため、微調整を重ねました。

写真2 PID製造工程の一部。試料の添加(左)、計量(中)、加熱(右)。製造の最適条件を見つけるために試行錯誤を繰り返した
高橋さんは、「外殻の製造方法や製造条件を見出すのには苦労しました」と語ります。「プロジェクトでは、権田教授のアドバイスを基に、組織由来の自家蛍光の影響を最小限にとどめるため、自家蛍光が強い波長域から離れた、赤色の蛍光波長のPIDを開発していましたが、最初に試作した粒子は蛍光色素が外殻から漏れやすくて悩まされました」(高橋さん)
膨大な数の製造条件を検討した結果、外殻とその中身となる有機蛍光色素の最適な組み合わせを見つけ出し、病気の指標タンパク質が少量でも可視化できるほど、輝度と耐光性が高く、粒子径も揃ったPIDの開発に成功しました(写真3、4)。

写真3 (左)PIDの電子顕微鏡像。粒子径が均一になっている(写真提供:コニカミノルタ)。 写真4(右)製品化された赤色蛍光PID。紫外線照射で強い蛍光発光が見られる
高橋さんは言います。「粒子径を揃えるには界面活性剤の働きを上手く利用しました。また、弊社の銀塩写真用粒子を揃える技術が、PIDに使えることもわかりました」
定量的な蛍光イメージング技術を実現
続いてコニカミノルタはPIDを使い、「定量的」に病気の指標タンパク質を把握するための蛍光イメージング技術の構築に取りかかりました。
当初、指標タンパク質の定量は、PIDの蛍光の輝点数を測定して行っていました。しかし、輝点は複数のPIDが一塊になっていても1輝点となってしまうため、指標タンパク質の量を正確に反映できないという問題がありました。高橋さんは、「1点に見える輝点でも10倍明るければ、そこにPIDが10個あるはずなのです。定量性の確立には、明るさとPID数の関係の理論化が必要でした」と説明します。
高橋さんは一つの試料について、蛍光顕微鏡によるPIDの蛍光像と、それとは別に電子顕微鏡によるPIDの粒子像を撮影して、両者を統合し、蛍光強度と粒子数の関係で検量線を作ってみることにしました(図1)。
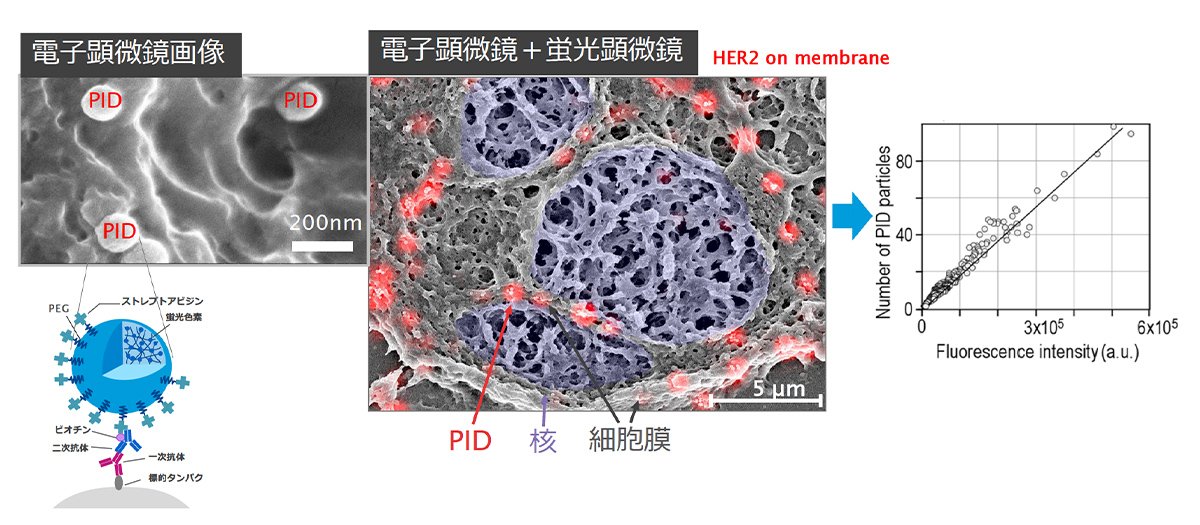
図1 電子顕微鏡像と蛍光顕微鏡像、そこから作成した検量線。PIDの1粒、1粒が確認できる。検量線からは、PIDの粒子数と蛍光強度が比例相関するとわかる (資料提供:コニカミノルタ)
電子顕微鏡像には、PIDが1粒1粒はっきりと写っていました。これを計数し、蛍光顕微鏡で観察される蛍光強度が、粒子数と比例相関していることを明らかにしました。この結果をもとに、PIDの蛍光信号から病気の指標タンパク質の量をPIDの粒子数として定量的に評価する、独自の解析ソフトウェアも開発しました(写真5)。
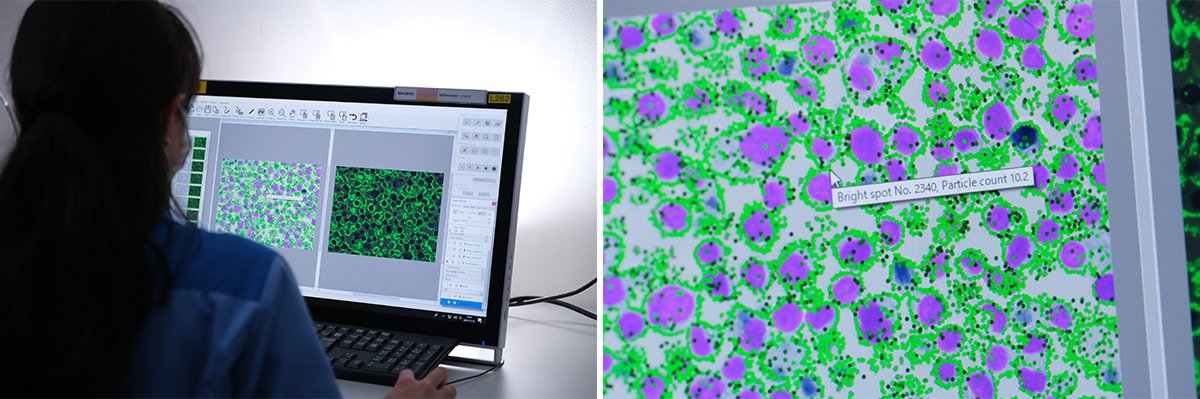
写真5 PIDを使ったイメージング画像からPIDの個数を自動算出するソフトウェアも開発。(左)操作イメージ、(右)算出結果
乳がんの病態組織の詳細な分類に成功
PIDの実用化が現実味を帯びてきた2012年頃、それが実際に医療現場で使えるかを検討するために、東北大学とともにプロジェクト内で取り組んだのが、東北大学関連の8病院が保有していた85検体の乳がん針生検試料の染色でした。
この検証は、大内教授、東北大学大学院医学系研究科 乳腺・内分泌外科の石田孝宣准教授(現:教授)、多田寛講師(現:准教授)、宮下穣助教(現:講師)らの尽力による患者標本の選定・収集や倫理委員会での承認取得、そして、渡辺准教授によるDAB染色を施した従来法での診断の確認や、医療現場で実際に行う手技で作成される組織切片の準備といった、万全な協力体制があって実現しました。
高橋さんは、「東北大学の先生方のアドバイスに基づき、すでに確定診断と治療が行われ、その予後もわかっている患者さんの検体を染色して、従来の染色法との比較を行いました」と説明します(写真6)。

写真6 (左)PIDで染色された細胞、(右)プレパラートに固定された細胞の染色作業 (いずれも再現イメージ)
染色のターゲットとしたのはHER2タンパク質です。これは乳がんの分子標的薬「トラスツマブ」の投与を判断する際の指標になります。HER2タンパク質の染色結果について、従来の「DAB染色」ではHER2の量を3+、2+、1+、0の4段階で区別していたのに対して、PIDを用いると従来法では区別できないような濃度領域の区分が可能であることが明らかになりました(図2)。
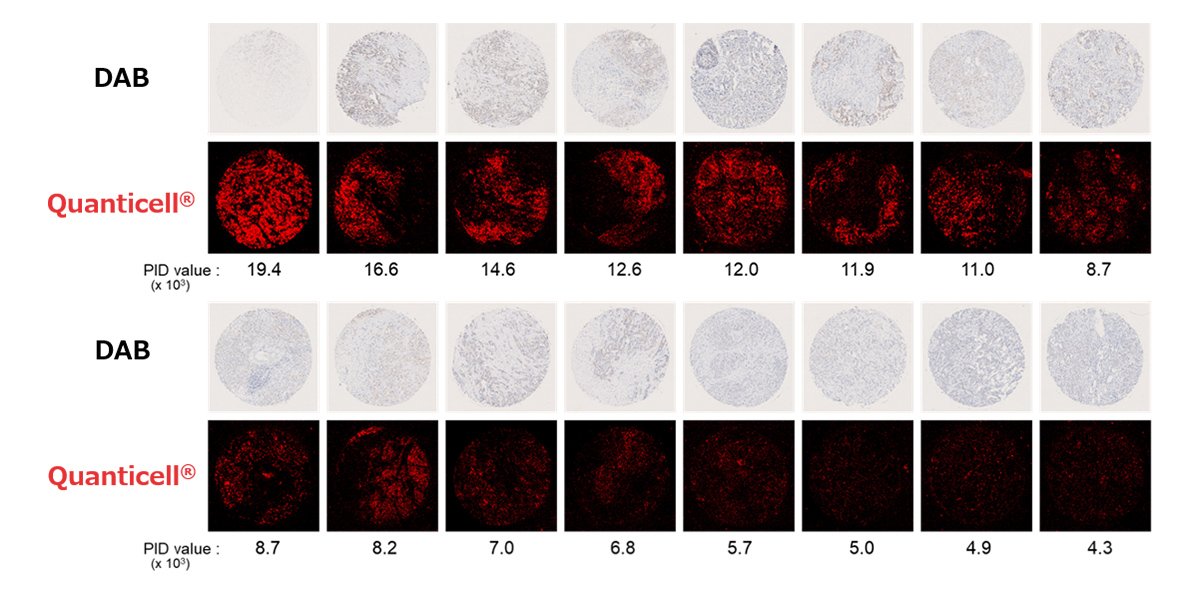
図2 DAB(1+)染色よりもPID染色の方がHER2タンパク質の発現量を詳細に捉えられる (資料提供:コニカミノルタ)
こうしてコニカミノルタは、東北大学大学院医学系研究科や東北大学病院の病理診断技術開発の研究メンバーの協力によって、高輝度かつ高耐光性のPIDの開発に成功し、その応用として、実際の医療現場でも適用可能な、高い感度と定量性を実現した病理組織の蛍光イメージング技術を構築・確立しました。
NEDOプロジェクトから得た気付き
中野さんたち開発メンバーはプロジェクトの中で、NEDOからいくつもの気付きがもたらされたと言います。中野さんは、「プロジェクトの最終目標がPIDの開発だけでなく、病理組織イメージングシステムの構築になったのも、NEDO側から提案を受け、実際に医療現場で使えるシステムを構築しなければ、PIDには価値がないことに気付かされたからです」と説明します。
中野さんは続けます。「私が『次はこういう風に考えている、あれをやろうと思っている』と伝えると、NEDOは非常に良く理解してくれました。3カ月毎に行われる報告会は大変でしたが、そこでの議論も『がんを治す』という、プロジェクト関係者全体が共有する目標へ向けて、実用化へのモチベーションの維持につながったと思います」
また高橋さんは、「外部的な視点でいろいろ指摘いただいたのが大きかったと感じています」と話します。NEDOがプロジェクトの良き理解者であり、時に適切な助言をしたことが、中野さん、高橋さんら、実際に研究開発を続けるメンバーの背中を強力に後押しました。
日仏共同研究でPIDの新たな価値の創出に挑戦
NEDOプロジェクト中盤の2012年4月、NEDOからプロジェクトメンバーに「フランスのパスツール研究所関連のベンチャー企業から研究者が来日するので会わないか」という連絡が入りました。
同年3月に開催された日仏のバイオ関連企業のビジネスマッチングイベントで、パスツール研究所と同研究所発のベンチャー企業であるバイオアクシャル社が共同研究先を探していたことを受けて、共同研究先としてマッチしそうな国内のバイオ関連企業などに、NEDOが声がけをしていたのです。中野さんはその知らせを聞いて、「世界的な研究所と一緒に何かできるとは思ってもみなかったですが、何があるかわからないので、取りあえず会ってみることにはしました」と言います。
NEDOによる橋渡しをきっかけに、両者間での情報交換が始まりました。パスツール研究所はかねてからコニカミノルタのPIDの性能の高さに注目していたこともあり、面会後もたびたび情報交換は続き、2013年12月には技術交流が始まりました。「そのようなタイミングで、NEDOから『パスツール研究所と共同研究をするなら、日仏コファンド事業を利用してはどうか』と提案されました」と中野さんは言います。
コファンド事業とは、日本企業と優れた技術を持つ外国企業とが、共同で国際研究開発プロジェクトを実施する際に、NEDOと相手国の支援機関が並行して、それぞれ自国企業の研究開発費用の一部を支援するものです。
中野さんは言います。「これにはパスツール研究所とバイオアクシャル社もたいへん喜んで、いろいろな研究テーマの提案がありましたが、『創薬に向けて、生きた細胞の動態を詳細に見る』というテーマに、PIDを使って挑戦することにしました」
創薬研究の過程では、医薬品の作用を正確かつ詳細に解析する必要がありますが、その一つの方法として「生きた細胞をイメージングする技術」が注目を集めていました。その技術にPIDを組み合わせ、生きた細胞内部での医薬品の動きや影響を詳細に調べることで、医薬品候補の効能をより正確に評価できるようになると考えてのことです。
こうしてコニカミノルタはパスツール研究所とバイオアクシャル社とともに「国際研究開発/コファンド事業/フランスBpifranceとの国際研究開発・実証事業」(2015~2017年度)に応募し、採択されました。
コニカミノルタはこの事業の中で、生きた細胞を染色できるPIDを新たに開発し、細胞内での医薬品の動態を観察することに成功しました。また、超解像顕微鏡システムを活用し、高精度な観察技術の基盤となるソフトウェアの開発にも貢献しています。これらの成果がその後のコニカミノルタの創薬支援ビジネスにつながっています。
NEDOが橋渡しした日仏機関の関係、そして中野さんをはじめとした開発者のチャレンジ精神がPIDの新たな活用先を開拓したのです。
開発のいま、そして未来
FOR THE FUTURE
組織染色サービスを事業化
NEDOプロジェクトで開発したPIDを基盤技術に、コニカミノルタは、2018年から組織染色サービス「QuanticellⓇ」を、製薬会社を中心に提供しています。
この組織染色サービスでは、染色したい病理検体などをコニカミノルタに送付すれば、染色結果がPIDの粒子数という定量的な形で得られます(写真7)。
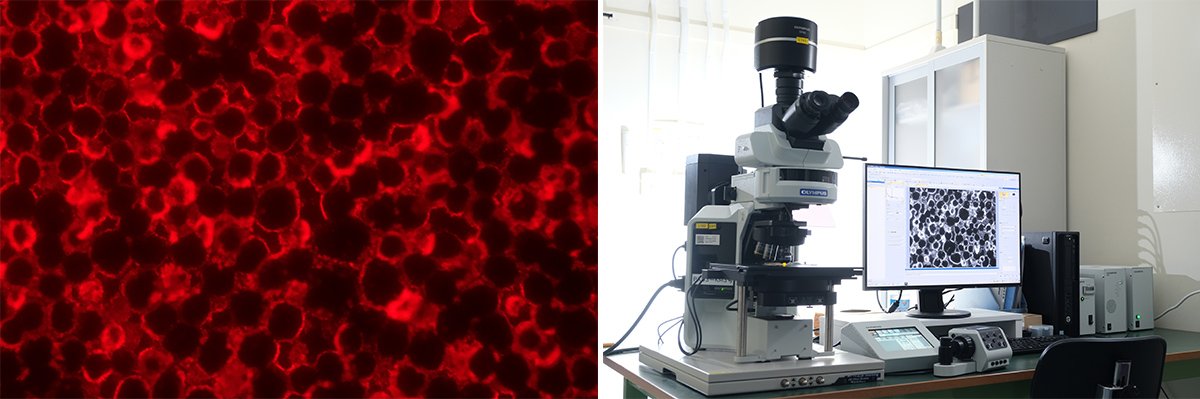
写真7 (左)PID染色の蛍光顕微鏡像。(右)タンパク質が赤く染色されている様子が蛍光顕微鏡で鮮明に捉えられる
このサービスを行っているうちに、気付きがあったと高橋さんは話します。「実は医療現場では、すでに確立された診断方法に代えてPIDを使うという考えには至りませんでした。代替するだけでも、臨床試験を行う必要があって大変だからです」
「一方で、新規に薬を開発していく初期段階の、例えば病気の指標タンパク質が非常に低発現で捉えにくい場合など、どの組織のどの場所に発現しているかを明らかにしたいとき、この技術が必要とされるとわかってきました」(高橋さん)
こうして創薬初期に、病気の指標タンパク質を捉えるのに使われたPIDは、その後、薬が実用化されてからは、投薬の有無を決める際に行われる「コンパニオン診断」の際に重要な役割を果たしていくことにもなります。
創薬支援のために緑色蛍光PIDを開発
NEDOプロジェクト「がん超早期診断・治療機器の総合研究開発」では赤色蛍光のPIDを開発しましたが、創薬現場が求める高度なイメージング技術を実現するために、コニカミノルタはさらに研究開発を続けました。その結果実現したのが、緑色蛍光のPIDです(写真8)。赤・緑色蛍光の2種を揃えたことにより、多重染色が可能になり、同時に2種類のタンパク質を高感度、高輝度でイメージングできるようになりました。これにさらに細胞膜や核などを従来法で同時に染色すれば、タンパク質がどこにあるのかという局在が明らかになります(図3)。これは病気の状態を判断するのに重要な情報です。

写真8 赤色蛍光と緑色蛍光のPID
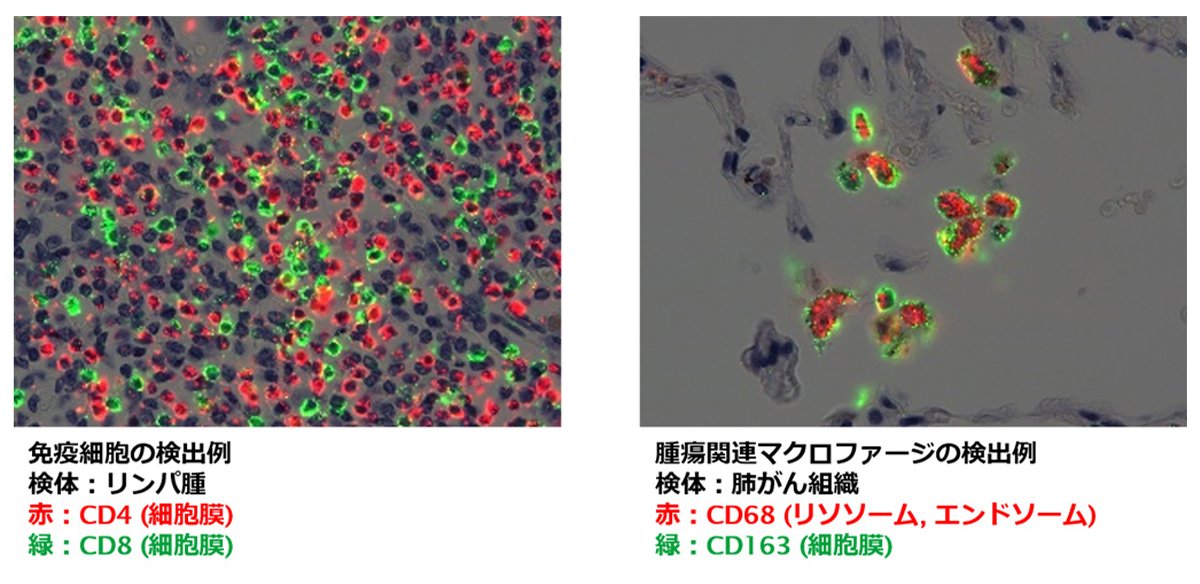
図3 赤・緑色蛍光のPIDによって、2種類のタンパク質の同時染色が可能に (資料提供:コニカミノルタ)
こうしてPIDの価値が明らかになるにつれ中野さんはこんな風に考えるようになりました。「バイオ分野にはほとんどといっていいほど、未解明なことが残されています。だから、後輩達にはPIDのような日進月歩のイメージング技術や材料技術で、チャレンジして欲しいことがたくさんあります」(写真9)

写真9 コニカミノルタの実験室「ナノパソコアラボ」
これからの医療の発展にはバイオの知識だけでなく、PIDのようなエンジニアリングやオプティクス、マテリアルなどさまざまな知識を組み合わせることが重要になります。こうした異分野、異業種のマッチングの成功には、「NEDOのプロジェクトマネジメントが果たしてきた役割は大きいです」と中野さんは評価します。
さまざまな技術の融合がもたらした成功事例として、PIDがこれから多くの人を救う医療分野を支えていくことが期待されています。
開発者の横顔
FACE
研究開発に夢や希望は抱かない。ただ、現実を直視するのみ
中野さんはPIDの研究開発のコンセプトメイキングから関わり、常にリーダーとしてプロジェクトを成功へと導いていきました。
「科学や技術の世界そのものは無慈悲な原理が支配していて、研究者や開発者の夢や希望を容易には叶えてくれません」
長年、材料の研究開発に向き合ってきた中野さんが、今感じていることです。それゆえ、時には研究テーマの中断といった非情な決断もしてきました。しかしそれは、エビデンスを収集し専門家に徹底的にヒアリングした上での、冷静な判断だったと言います。
「研究開発はエベレスト登山みたいなものです。険しい道を行くのですから、人々の言葉に耳を傾けます」
入社した1980年代後半には、磁気ビデオテープの開発を担当し、自分の製品が市販されるという喜びを経験しました。一方で、時代とともに所属部署が消えていくのを目の当たりにもしました。それをきっかけに、「やる以上は実現していかなくてはだめだ」と考えを変えたと言います。
それが社内では新分野だったヘルスケア部門へと異動した理由でした。2020年に定年退職し、現在は研究開発の現場を離れましたが、現役開発者にはPIDを育てて欲しい一方、その成功にこだわらないことも重要と伝えていると話します。

公益財団法人 コニカミノルタ科学技術振興財団
理事
中野 寧さん
経験を武器に新たな技術開発に向かいたい
高橋さんは高輝度ナノ粒子開発において、時には材料開発に従事し、時には東北大学で病理を学び、研究開発の主力となってきました。現在は、「QuanticellⓇ」サービスのリーダーを務めています。
もともと無機材料の専門家で、前職では自動車用の触媒の開発を行っていましたが、「何かほかのことをやりたい」と選んだのが医療分野でした。当時、コニカミノルタは新事業としてバイオ・医療分野に力を入れ始めており、高橋さんの希望とマッチして、2007年にコニカミノルタのヘルスケア事業部に採用されました。
現在は、プロジェクトを通して習得した知識と技術を背景に、製薬会社向けにPIDの技術営業を行っています。
「PIDが創薬支援技術として世の中に認められたら、新しい技術開発に携わりたいと思っています。本プロジェクトを通して研究開発の立ち上げの難しさや、コンセプトがどれだけ大事か、身に染みてわかったつもりです。それを自分の力で実践してみたいのです」
「新しいものに果敢に挑戦していく」という中野さんの開発者精神は、高橋さんへと確実に受け継がれています。

コニカミノルタ株式会社
ヘルスケア事業本部(HBH) プレシジョンメディシン(APM)事業部
システム開発部 創薬支援グループ グループリーダー
高橋 優 さん
 なるほど基礎知識
なるほど基礎知識
高輝度蛍光ナノ粒子PIDと蛍光イメージング技術
高輝度蛍光ナノ粒子PIDは、図のような、無機物でできた球形の外殻の中に、数万個の有機蛍光色素が詰まった粒子です(図4)。
そのため、一般的な有機蛍光色素の約3万倍、量子ドットの約100倍明るく光ります(図4 棒グラフ)。また、粒子全体として退色しにくい性質をもっています(図4 折れ線グラフ)。
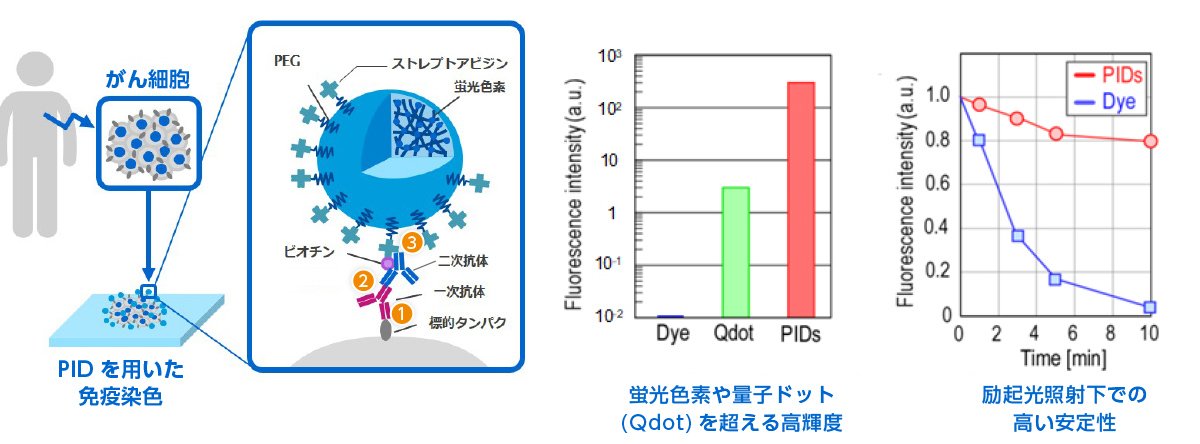
図4 PIDとその性質 (資料提供:コニカミノルタ)
PIDを使ったイメージングは、「抗体が抗原を認識して結合する原理」を利用することから、免疫組織化学法の一つに分類されます。染色では、一次抗体、二次抗体、そしてPIDの順で、検体に反応させます。
まず、がんなどの疾患に特有のタンパク質を標的タンパク質として、この標的タンパク質を認識する抗体を準備します。これを一次抗体として、検体の標的タンパク質に結合させます(図4内の①)。
続いて二次抗体を一次抗体に結合させます。二次抗体は、一次抗体の定常領域と呼ばれる、標的タンパク質と結合しない領域に結合するように設計されています(図4内の②)。
また、二次抗体にはビオチンという小分子が付けられており、この小分子にはストレプトアビジンというタンパク質と結合する性質があります。
PIDにはストレプトアビジンが付けられているので、PIDは一次抗体、二次抗体を介して標的タンパク質に結合することになります(③)。
 NEDOの役割
NEDOの役割
「がん超早期診断・治療機器の総合研究開発/超早期高精度診断システムの研究開発:病理画像等認識技術の研究開発/病理画像等認識基礎技術の研究開発」
2010~2014年度
NEDO内担当部署:バイオテクノロジー・医療技術部 [事業承継部門:ロボット・機械システム部、現:ロボット・AI部]
我が国において、がんは死因の第1位を占めており、より早い段階での診断と精度の高い治療を行う技術が求められています。また、がん患者のQOLの向上や早期の社会復帰のためには、身体的な苦痛を伴わず、入院期間が短い治療技術の確立が必要不可欠です。
そこでNEDOは本プロジェクトで、血液中のがん指標分子の検出法や組織画像を活用した高精度な診断システム、体に対する負担が少ないがんの治療法・治療機器などの開発を行いました。
本プロジェクトの成果の一つとして、コニカミノルタ株式会社は東北大学との共同研究で、がんタンパク質などを蛍光標識する「PID(Phosphor Integrated Dot)」を開発し、病理組織などを高精度かつ定量的に解析する技術を実現しました。現在、この技術は「Quanticell®」としてサービス展開されています。
関連プロジェクト
お読みいただきありがとうございました。
ぜひともアンケートにお答えいただき、
お読みいただいた感想をお聞かせください。
いただいた感想は、
今後の連載の参考とさせていただきます。