
CONTENTS
概要
イントロダクションプロジェクトの突破口
ゼブラフィッシュの研究経験から橋本電子工業に白羽の矢
開発のいま、そして未来
機能性食品の開発やがんの個別化医療への活用も
開発者の横顔
治療できない患者さんを救いたい一心で概要
INTRODUCTION
新薬開発では、実験動物を対象に安全性や効果を確かめておかなければなりません。そのためには人間の病気を再現したモデル生物が不可欠です。NEDOの「大学発事業創出実用化研究開発事業」では、三重大学大学院医学系研究科の田中利男教授らが、モデル生物となるヒト疾患モデルゼブラフィッシュを開発。さらに、「イノベーション実用化ベンチャー支援事業」では、橋本電子工業が加わり、数多くのゼブラフィッシュを同時に扱うことができるZF(ゼブラフィッシュ)プレートの開発に成功しました。
開発への道
BEGINNING
遺伝情報から創薬する“ゲノム創薬”にも実験動物が必須
20世紀の創薬は、マウスなどの「実験動物」や研究用の「ヒト細胞」に膨大な数に上る新薬候補化合物を与え、有効性と安全性を選択することによって進められていました。
その後、2003年には「ヒトゲノムシークエンス計画」が完了し、人間の遺伝情報のすべてが解析されました。これを分析することで、どの遺伝子がなんの疾病にかかわっているのかがわかるようになり、21世紀では「ゲノム創薬」が盛んに行われるようになりました。
しかし、三重大学大学院医学系研究科の田中利男教授はこう説明します。
「ゲノム創薬でも、動物を用いた薬効定量のスクリーニング実験は欠かせません。その際、人間で効果を示す薬を開発するのですから、人間により近い動物を用いるのがスクリーニングには有効だという考えが一般的で、DNAの塩基配列の80%が人間と同じであるマウスを用いるのが好ましいとされてきました。しかし、実験にマウスを用いると、新薬候補の各化合物の効果を確認しようとすれば、やはり大きなコストがかかってしまいます」
そこで、田中教授は、ゼブラフィッシュをスクリーニングに用いる創薬を提唱しています。体長3mmほどの稚魚を使えば、マウスより簡便に候補化合物の選択ができるからです。ゼブラフィッシュでも約70%のDNA塩基配列が人間と同じです。
ただし、ゼブラフィッシュを創薬スクリーニングに利用するには、乗り越えなければならない課題がありました。
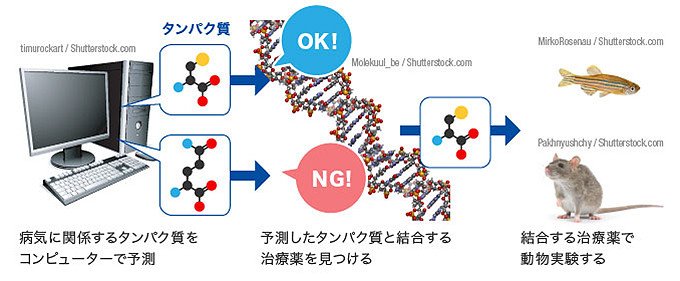
図1 ゲノム創薬の流れ
ゲノム創薬とは、人間の遺伝子情報から疾患の原因になる遺伝子やその遺伝子がつくるタンパク質の情報を調べ、薬をつくる方法
ゼブラフィッシュは遺伝子の“ノックアウト”ができない!?
人間の病気を治療したり病状を緩和したりする効果を調べるには、実験動物に人間の病気にかかってもらう必要があります。人間の病気を再現したヒト疾患モデル生物を作製するには、病気にかかわる遺伝子を改変する遺伝子操作技術が用いられます。病気にかかわる特定の遺伝子そのものを破壊することができれば、その遺伝子の情報に従って合成されるタンパク質が働かず、病的な状態にすることができるからです。こうした特定の遺伝子を壊す手法は「ノックアウト」と呼ばれます。ところが、ゼブラフィッシュの遺伝子には、このノックアウトができなかったのです。
遺伝子のノックアウトができなければ、別の方法でヒト疾患モデルゼブラフィッシュをつくらなければなりません。折しも公募されていたNEDOの「大学発事業創出実用化研究開発事業」(2006~2008年度)に田中教授の研究グループは応募、採択され、ヒト疾患モデルゼブラフィッシュの開発に取り組みました。

図2 田中教授の研究室ではさまざまなヒト疾患モデルゼブラフィッシュを作成している

図3 研究室内の様子
数百に上る水槽ごとに、さまざまな条件でゼブラフィッシュを飼育している
遺伝子に異常を起こす変異原性物質と呼ばれる薬剤を用い、ゼブラフィッシュ遺伝子を改変する「ランダム・ミュータジェネシス」と呼ばれる方法では、多くの改変遺伝子が得られますが、変異原性物質による遺伝子の異常はランダムで、どこにどんな異常が起こるかはわかりません。そのため、誕生したゼブラフィッシュを詳しく調べて、ヒト疾患モデルとして使えるかどうかを確認する必要がありました。
そんな田中教授らの研究を大きくあと押しする技術が登場します。アメリカの研究者によって開発された「ゲノム編集」と呼ばれる技術です。
DNAの特定遺伝情報を狙ってピンポイントに破壊する技法で、従来のマウス遺伝子ノックアウトよりも簡単なモデル生物の開発をゲノム編集は可能にしてくれたのです。
田中教授はここまでの経緯について、こう振り返ります。
「さまざまなヒト疾患モデルゼブラフィッシュが開発された現在ですら、創薬研究のモデル生物にゼブラフィッシュを使うことに懐疑的な研究者がいるのも事実です。それをサポートしてくれたのですから、いかに先見性をもってNEDOが私たちの研究を支援してくれたかがわかります。支援がなければ、ヒト疾患モデルゼブラフィッシュはできなかったといっても過言ではありません」
ヒト疾患モデルゼブラフィッシュを活用するには……
ただ、膨大な数にのぼる新薬候補を調べていくには、ヒト疾患モデルゼブラフィッシュの開発だけでは不十分だと、田中教授は指摘します。
「マウスに比べてゼブラフィッシュは小さいので、限られたスペースでも大量に飼育できるというメリットがあります。しかし、膨大な数の化合物をスクリーニング(ハイスループット・スクリーニング)することは人間の能力の限界を超えています。コンピューターなどに接続して自動的に解析できる研究ツールを開発しなければなりません」
例えば、ゼブラフィッシュを用いて心不全の薬効を調べるには、ゼブラフィッシュの拍動を詳しく解析しなければなりません。微小なゼブラフィッシュが相手では、顕微鏡での観察になります。しかし、多くのゼブラフィッシュの拍動変化を正確に観察して薬効を評価することは、決して簡単ではありません。しかも、調べる対象が膨大な数になれば、さらに困難になります。

図4 肥満症のモデル生物となるゼブラフィッシュ(提供:田中利男教授)

図5 体が透明なゼブラフィッシュ「三重小町(MieKomachi)」(提供:田中利男教授)
プロジェクトの突破口
BREAKTHROUGH
ゼブラフィッシュの研究経験から
橋本電子工業に白羽の矢
田中教授が思い描くゼブラフィッシュを用いた大規模な創薬スクリーニングを実現するためには、数多くのゼブラフィッシュを観察して、新薬候補の化合物の効果を評価できる研究ツールが必要です。前述のとおり新薬候補の化合物は何万、何十万にのぼるだけに、将来的にはコンピューターで自動化し、フルオートメーションで薬効を評価していくことが望まれます。
そのための第一ステップとして、同時に多くのゼブラフィッシュを観察できる「ZF(ゼブラフィッシュ)プレート」の開発が進められることになりました。
実際に開発に取り組んだのは、三重県松阪市に拠点を置く橋本電子工業です。電子機器の開発を手がけてきた企業ですが、1990年代前半から新たな分野への活路を見いだすため、医療やバイオ分野の技術開発にも取り組んできました。
橋本電子工業がZFプレートの開発に取り組むことになった経緯について、代表取締役社長の橋本正敏さんがこう説明します。
「ZFプレート開発とは別に、2008年にリポソームを全自動で製造する装置を開発しました。リポソームというのは非常に微細な脂質のカプセルで、ここに治療薬などを入れて、標的組織にだけ送り届ける薬物送達システム(DDS=ドラッグ・デリバリー・システム)への活用を目指したのです。その過程で微細粒子を扱う技術を得ることができ、ゼブラフィッシュの卵や稚魚を操作する技術の開発につながりました」
橋本電子工業の微細粒子取り扱い技術の高さを知った田中教授は、ゼブラフィッシュを創薬スクリーニングに用いるZFプレートの開発に協力してもらうならば、橋本電子工業こそが適任と考えたのです。
「創薬スクリーニングに有望なヒト疾患ゼブラフィッシュが開発できたのですが、ZFプレートの開発に取り組みはじめたころは、まったく注目されませんでした。だからこそ、ゼブラフィッシュを扱う技術の開発で、橋本電子工業に協力をお願いしたのです」と田中教授は語ります。
ゼブラフィッシュを整列させるために試行錯誤
ゼブラフィッシュ創薬の先見性に注目していたNEDOは、ZFプレートの開発を「イノベーション実用化ベンチャー支援事業」として採択、2013年度から「ゼブラフィッシュスクリーニング用プレートシステムの開発」が進められることになりました。研究資金の目途は立ったものの、一度に多くのゼブラフィッシュを観察するプレートを開発することは決して簡単ではありませんでした。
その難しさについて、ZFプレートの開発に携わった商品設計グループの小幡勝さんがこう語ります。
「研究用に用いられるプレートには一定の規格があります。そのため、ZFプレートの開発でも既存規格にある96穴のプレートを利用して、そこにゼブラフィッシュを入れる容器を組み込むことにしました」

図6 既存のマイクロプレート

図7 既存のマイクロプレートを改良したZFプレート
通常、新薬候補の薬効など生化学的な研究を行う場合、試験したい細胞を入れる穴(ウェル)が開いたマイクロプレートが用いられます。細胞や試薬の量に応じてウェルの大きさが異なるプレートが用意されており、ウェルの数は6、24、96、384……と決まっています。ウェルの中でなにが起こっているのかを観察するためのイメージング装置も、既存のプレートの規格に合わせてつくられているので、規格外のプレートではたとえ実用化できても普及させることは困難です。小幡さんらは既存の96穴のプレートを基材にゼブラフィッシュを飼育できるウェルを組み込むことにしました。
新薬候補を与えて、その効果を判定するには、96穴に入れたゼブラフィッシュが一律に整列してくれなければなりません。小さな穴とはいえ、体長3mm程度の稚魚なら自由に泳ぎ回ることができます。観察するために麻酔をかけたとしても、ばらばらの方向を向いていては、ウェルごとに異なる化合物を加えたときの効果の違いを、一律の条件で比較することは難しくなります。
小幡さんがこう続けます。
「ゼブラフィッシュを入れるウェルをすり鉢状にして、下に開けたスリットに誘導することで、整列させようと考えました。容器の下面に溝を切っておいて、そこから麻酔液を抜いて、スリットに誘導させる原理です。しかし実際にやってみると、すり鉢状にしたウェルの形状によって、ゼブラフィッシュが壁面に付着して動かなくなってしまいました」
途中で付着してしまっては、スリットにゼブラフィッシュを整列させることはできません。そこで、麻酔液を抜いた後、定量の麻酔液を流し込んでウェルの中に小さな水流をつくり出し、ゼブラフィッシュを壁面からはがして、スリットに誘導することにしました。飼育、麻酔処理、スリットへの整列などを自動化するための装置であるワークステーションも製作しました。
確実にゼブラフィッシュをスリットに誘導するためには、すり鉢状の角度を変えては試作品をつくり、ゼブラフィッシュがスリットに整列する割合を調べて最適な形状を見いだす必要がありました。
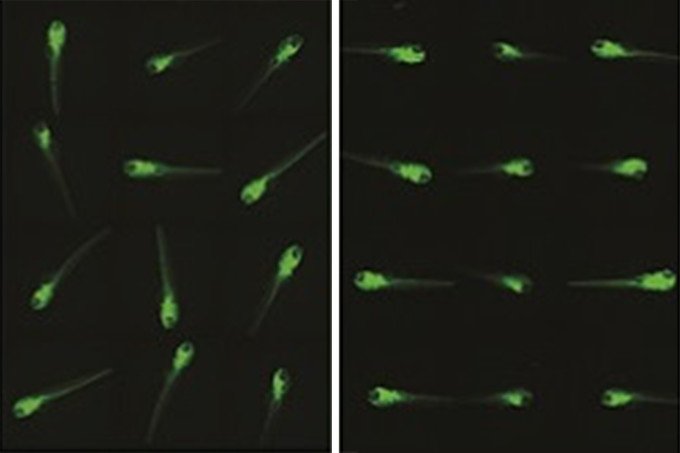
図8 従来のプレートとZFプレートを用いた場合の比較
左)従来のプレートでのゼブラフィッシュの様子。右)ZFプレートで整列した様子(提供:橋本電子工業)
基材として採用したプレートは、四角く間仕切りされたものでした。四角形のスペースに四角形のウェルを組み込もうとすると、高精度にプラスチックを成型しなければなりません。そこで、四角の中に丸いウェルを組み込むことにしました。これなら4点で接するだけなので、各社製のプレートの成型精度が多少悪くても収まりやすくなります。
当時のことを小幡さんがこう振り返ります。
「最適なウェルの形状を見つけ出すのは試行錯誤の連続でした。決して楽な作業ではありませんでしたが、困難だからこそ、いっそう力が入りました」
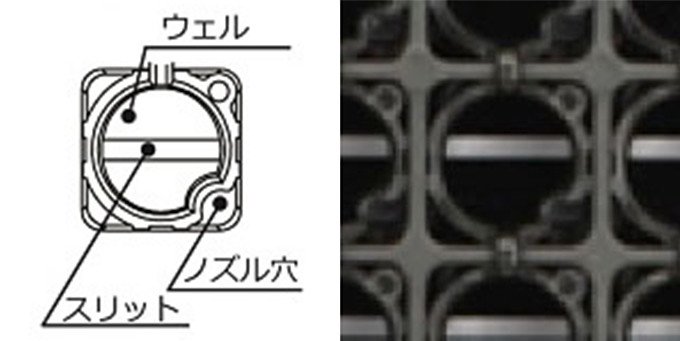
図9 マイクロプレートに組み込んだウェル
四角形のスペース内に丸形のウェルを組み込んだ(提供:橋本電子工業)
開発のいま、そして未来
FOR THE FUTURE
機能性食品の開発やがんの個別化医療への活用も
このような小幡さんの努力により、数多くのゼブラフィッシュを同時に観察することができるZFプレートが開発できました。自動で飼育液の注入、飼育液と麻酔液の交換、スリットへの整列などができるワークステーションも試作機が完成したのですが、これもいっしょに実用化すると高価になってしまうため、現実的ではありません。

図10 ZFプレートを自動で処理するワークステーションも試作
創薬スクリーニングの材料としてゼブラフィッシュは有望であるとはいえ、いまだ新薬開発の研究現場では、従来のマウスや細胞を用いた研究が主流です。ゼブラフィッシュの実用性を知ってもらって、ZFプレートを利用してもらおうというのに、最初から高額なワークステーションを購入してもらわなければならないとしたら、普及は見込めません。
そのため、他の方法でZFプレートを利用する手順を開発しなければなりませんでした。
これを担当したのが同社営業グループの坂口圭さんでした。坂口さんはこう語ります。
「手作業で水を流し込もうとしても、ワークステーションを使ったときのような水流はつくれず、うまくスリットにゼブラフィッシュを整列させることはできませんでした。さまざまな方法を試した結果、遠心分離器を利用してスリットに誘導することにしました。遠心分離器は、生命科学分野の多くの研究室で一般的な装置だからです」
ただしひと口に遠心分離器を利用するといっても、ゼブラフィッシュをスリットに誘導させるのに最適な回転速度や時間を見いださなければなりません。坂口さんは繰り返し実験を行い、最適な条件を見つけていきました。
こうしてZFプレートの使い方が確立されたことで、専用ワークステーションの実用化は先送りにして、まずはZFプレートだけを販売することにしました。ゼブラフィッシュを材料にした実験がどこでも簡単に行えるようになったわけです。
今後、創薬スクリーニング用のモデル生物としてゼブラフィッシュの有用性が認められていけば、このZFプレートを利用した研究による新薬開発が、いっそう期待されます。
一方で、ゼブラフィッシュの創薬スクリーニング以外の利用方法も検討されています。そのひとつが、食品に含まれる有効成分の試験です。
すでに田中教授の研究室では食品メーカーの協力の下、食品の成分を与えた場合にゼブラフィッシュがどのように変化するかを調べる研究を進めています。例えば、肥満症のモデルゼブラフィッシュをやせさせる効果をもった食品成分が見つかれば、痩身効果のある機能性食品が実用化できるかもしれません。
さらに田中教授がこう続けます。
「がんの個別化医療への応用も開始しています。現在、がんの病理診断は、患者さんの体から採取したがん組織を病理医が観察して、がんのタイプ(組織型)を調べています。診断されたタイプから腫瘍内科医は効くと思われる抗がん剤を選んで患者さんに投与していますが、必ず効く保証はありません。そうではなくゼブラフィッシュを用いれば、患者さんから採取したがん細胞をゼブラフィッシュに移植して、抗がん剤が効くかどうかを確かめたうえで、患者さんに投与することが可能になります。患者さんのがんに合わせた個別化医療が実現するわけです」
こうしたがんの個別化医療は、ゼブラフィッシュではなくマウスを用いてでもできるかもしれません。しかし、投与の候補となる抗がん剤の数だけマウスを用意し、患者さんの多くのがん細胞を移植したうえで、抗がん剤を試すのはコスト的にまず不可能です。一方、小さなゼブラフィッシュの稚魚をZFプレートに投入する手法なら、医療費をそれほど増大させずに個別化医療を実現できる可能性が高まります。
そのための研究が田中教授の研究室と三重大学病院との連携の下で進められており、今後、ゼブラフィッシュががん治療に大きな革新をもたらすかもしれません。
ゼブラフィッシュを用いた生命科学研究はいまだ黎明期にあるといえます。創薬スクリーニングに用いるなら、ゼブラフィッシュよりもマウスのほうが有効だと考える研究者もまだ多く、ゼブラフィッシュの利用が広まるには、もう少し時間がかかるでしょう。
そのため、「ゼブラフィッシュ創薬研究会」と「小型魚類産業協会」を設立しました。この研究会では、国内外の生命科学の研究者に向けて、ゼブラフィッシュの可能性を広く啓蒙する活動をしています。
近い将来、ゼブラフィッシュは創薬研究に欠かせない研究材料となり、新薬開発を進める原動力になるだろうと大いに期待されています。
開発者の横顔
FACE
治療できない患者さんを救いたい一心で
研修医のころ、田中利男教授はあるがん患者さんの担当医になりました。
「当時、医療現場ではがんは告知しないのが一般的で、患者さんから『私は治りますか?』と問われても、本当のことは言えませんでした。そんな経験から、このまま臨床医となって目の前の患者さんを救うよりも、研究医となっていまの医療技術では治療できない患者さんを救いたいと考えるようになりました。ゼブラフィッシュの研究も、新薬開発を後押しする技術を開発することで、ひとりでも多くの患者さんを救えたら、という思いをもって進めています」

三重大学大学院医学系研究科 教授/
三重大学メディカルゼブラフィッシュ
研究センター長
田中利男さん
医療・バイオ分野に会社の将来をかけた
橋本電子工業代表取締役社長の橋本正敏さんは、1983年に会社を設立。当初は電磁リレー用の特性検査装置など、おもに電子制御機器の開発、製造を手がけていました。
「技術が普及するに従い、人件費の安い国で製造されるようになって、価格面では輸入品に太刀打ちできなくなってしまいます。そこで、最先端の技術を開発することで会社の生き残りを図ろうと考え、医療・バイオ分野への進出を模索していました。その過程で人工筋肉や医療機器などの開発に取り組み、そうした経験が田中先生とのゼブラフィッシュの共同研究につながったのだと思います」

橋本電子工業株式会社
代表取締役社長
橋本正敏さん
定年後の再就職で、再び研究の道へ
医療機器を開発・製造している大手電子機器メーカーの研究員だった小幡さんは、若いころ、血液分析技術の開発に取り組んでいましたが、人事異動により、三十代半ばでマネージメント職に就任。
「直接、研究開発に携わることがなくなりました。それでも胸に秘めた研究への思いは消えることはなく、定年退職を機に橋本社長に直談判して、研究職として再雇用してもらうことができたのです。そのころ、ZFプレートの研究開発がはじまったので、その責任者となりました。その後は連日連夜、ゼブラフィッシュと格闘したものです」

橋本電子工業株式会社
商品設計グループ特命担当
小幡 勝さん
社内公募に興味をもち、担当に立候補
小幡さんが開発したZFプレートを手作業で利用するための手順(マニュアル)の開発を担った坂口さん。橋本電子工業に勤めるまで、半導体メーカーに勤務して、マイクロコンピューターの開発に携わっていたといいます。
「半導体メーカーではゼブラフィッシュのような生物を扱うことなどありませんでしたが、橋本電子工業に移り、ゼブラフィッシュ関連事業の担当者が社内公募されたとき、自ら手を挙げました。実は、大学生のときに所属していた研究室で、バイオセンサーの研究にかかわる経験があったからです。そのため生物を相手にした機器の開発には、非常に興味がありました」

橋本電子工業株式会社
営業グループ新規ドメインチーム
坂口 圭さん
 なるほど基礎知識
なるほど基礎知識
フォワード薬理学とリバース薬理学を
ともに可能にするゼブラフィッシュ
創薬スクリーニングは、従来、実験動物や細胞を用いて行われており、こうしたアプローチは「フォワード薬理学」と呼ばれます。フォワード薬理学では、実験動物の体に現れた薬効を調べたうえで、人間を対象にした臨床試験に進むので、臨床試験の段階で、期待したほどの薬効が確認できずに新薬開発が頓挫する確率は低く抑えられていました。
これに対して、ヒトゲノム計画の完了宣言後に盛んになったゲノム創薬は、遺伝情報に基づいて病気にかかわる分子に結合する化合物を設計するという、理論的なアプローチです。そもそも病気にかかわる分子をターゲットにした化合物を用いることができるため、効率的なスクリーニングが行えると考えられます。こうしたアプローチは、目に見える薬効を頼りに開発を進めるフォワード薬理学と区別するため、「リバース薬理学」と呼ばれます。
ゼブラフィッシュを用いた創薬スクリーニングでは、標的分子に合わせて理論的に化合物を設計するリバース薬理学的なアプローチが可能なだけでなく、ゼブラフィッシュの体に現れた変化から薬効を調べるフォワード薬理学的なアプローチも可能となっています。
昨今、遺伝子がすべて解読され、かつマウスに比べて飼育コストのかからないゼブラフィッシュへの関心が高まってきています。さらに、ゲノム編集などの遺伝子操作技術を用いてつくられたヒト疾患モデルゼブラフィッシュについても、今後、遺伝子が詳しく調べられることで、病気に関連する分子も明らかになっていくことが期待できるでしょう。
 NEDOの役割
NEDOの役割
「イノベーション実用化ベンチャー支援事業」
(NEDO内担当部署:イノベーション推進部)
研究開発型ベンチャー企業等にとって、実用化開発は事業化に至る前の非常にリスクの高いフェーズです。そこでNEDOでは、おおむね3~5年以内に実用化が可能な具体的な計画を有するものを対象に、研究開発型ベンチャー企業等が持つ優れた先端技術シーズや有望な未利用技術を活用した実用化開発を支援しました。
本事業の採択に際し、NEDOは技術面のみならず事業化見込みに際してもあらゆる角度で審査を行いました。技術面では、実用化開発の基となる研究開発の有無をはじめ、技術の新規性や目標設定のレベル、特許やノウハウの優位性を審査。目標や課題、また課題解決の手段が明確化しているかどうか、研究計画に対する費用対効果も含めた研究計画の妥当性といった技術面の評価を行いました。さらに事業化評価として、「新規市場創出効果」や「市場ニーズの把握」「開発製品・サービスの優位性」、さらに事業化体制や事業化計画の信頼性も検討。また、地域経済活性化への貢献等も見越して採択を行っています。
研究開発型ベンチャー企業等のリスクを低減させるだけではなく、研究開発成果を迅速に実用化・事業化に結び付けることで、イノベーション創出のための基盤強化を実施しました。
関連プロジェクト
- 「大学発事業創出実用化研究開発事業/ホール・アニマル・ドラッグ・スクリーニングの実用化研究」(2006~2008年度)
- 「産業技術研究助成事業/新規がん遠隔転移モデルゼブラフィッシュを用いたハイスループットin vivo治療標的分子探索システムの開発研究」(2009~2011年度)
- 「イノベーション実用化ベンチャー支援事業/ゼブラフィッシュスクリーニング用プレートシステムの開発」(2013年度)
お読みいただきありがとうございました。
ぜひともアンケートにお答えいただき、
お読みいただいた感想をお聞かせください。
いただいた感想は、
今後の連載の参考とさせていただきます。



