概要
INTRODUCTION
世界最速のスキャンスピード
2,000コマ/秒
生命現象を解き明かすために、細胞という生命の単位の中で遺伝子やタンパク質などの分子の動きを可視化することが重要ですが、電子顕微鏡では電子線を使うなどのために細胞を生きたまま観察することはできません。NEDOプロジェクト「細胞内ネットワークのダイナミズム解析技術開発」を通して横河電機は細胞の動きをそのまま観察できる光学顕微鏡「共焦点レーザースキャナ」の開発に成功しました。高い三次元での分解能を実現した高性能なスキャナで撮った細胞の写真は何度も「Nature」の表紙を飾りました。NEDO成果を活用した共焦点レーザースキャナは2007年に製品化。以降800台以上を販売し、バイオ分野の最先端研究に貢献しています。
開発への道
BEGINNING
生きたまま細胞や組織の生命現象を観察する「ライブイメージング」
いま、生命現象を解き明かす手段として、生きたまま細胞や組織の生命現象を観察する「ライブイメージング技術」が注目されています。生命科学では、遺伝子やタンパク質など分子レベルでの研究がさかんに行われてきましたが、個々の分子を見るだけでは複雑な生命現象を解明できません。それらの分子が細胞内でどのようなはたらきをしているのか、細胞の中で起きている現象を調べることが重要視されるようになってきました。そのためには、生きている細胞で内部の分子の動きを直接観察することが必要です。
細胞の内部構造を観察するためには、一般的には高い分解能をもつ電子顕微鏡を使います。しかし、この手法では細胞を薄く切ったり、電子線をあてたりしなければなりません。これでは細胞を生きたまま観察することはできません。
光学顕微鏡を使えば、細胞を生きたまま見ることができますが、解像度に限界があり詳細な内部構造まで観察できませんでした。また、従来の技術では、組織から取り出したときの状態を見るのみで、細胞内の挙動までは観察ができませんでした。
最近になって、タンパク質を標識する蛍光プローブが次々と開発され、細胞内のタンパク質分子を見ることができるようになりました。また、レーザー顕微鏡などが新たに開発され、細胞の三次元解析も可能になっています。このような技術進歩により、ライブイメージング技術の発展への期待がますます高まっています。
細胞の中の動きも見えるようにして欲しい
生命科学研究の現場では、細胞の三次元イメージングが可能な共焦点レーザー顕微鏡が、ライブイメージングの重要なツールとして広く使われるようになってきました。共焦点レーザー顕微鏡は、レーザー光を対物レンズで集め一本のビームにして試料に焦点を合わせます。レーザーで試料面をスキャンし、試料から出てきた光を検出し画像にします。レンズから見た距離がばらばらな厚みのある試料でもボケのない像を得ることができます。
レンズの結像面に置かれる検出器の前にピンホールをおいて、観察しない面からの蛍光シグナルを除くため、鮮明な画像を得ることができます。しかし、従来の方法では、1枚の画像を得るためには、1秒以上のスキャンが必要でした。これでは、細胞内の動態を捉えるには時間がかかりすぎます。それゆえ「細胞の中の動きも見えるようにしてほしい」と望む研究者の声が強かったのです。
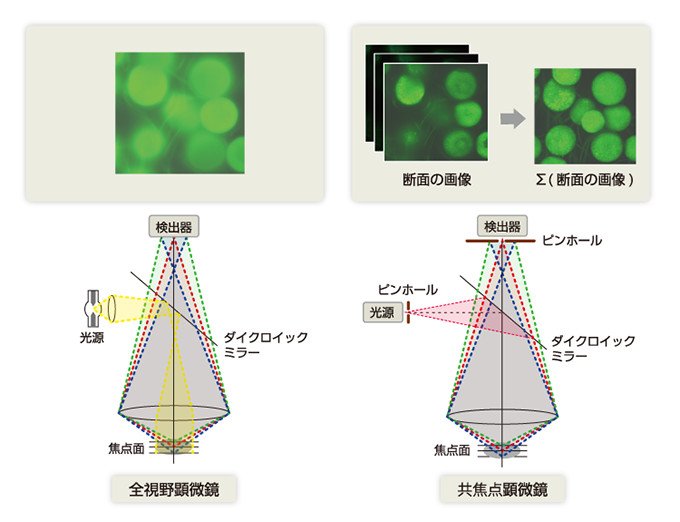
図1 共焦点顕微鏡の原理
ライブイメージング分野への進出
横河電機が、共焦点スキャナの開発を始めたのは今から20年ほど前のことです。同社では計測機器や制御機器の開発を行ってきましたが、社長の「もっとやわらかいものも計測してみたら」の声で、バイオや環境分野に応用できる共焦点レーザースキャナの開発に乗り出しました。異分野への進出ゆえの慣れない研究開発の末、1997年に1号機「CSU-10」が発表されました。このCSU-10は、生きた細胞の動きが見える画期的なものでした。
横河電機では、CSU-10の機能をさらに向上させるとともに、ライブイメージングの発展をめざして、2003年から5年間、NEDOプロジェクト「細胞内ネットワークのダイナミズム解析技術開発」に参加し、理化学研究所や、産業技術総合研究所、日本放送協会放送技術研究所(NHK技研)、日立国際電気とともにリアルタイム三次元顕微撮像システムの開発や、細胞内分子動態の可視化を進めました。
画像ご提供:
東京大学循環器内科・TSBMI、JST さきがけ 西村智先生
東京大学 新領域創成学科 杉浦清了先生
なお、本データはNEDOプロジェクト内のものではありません。
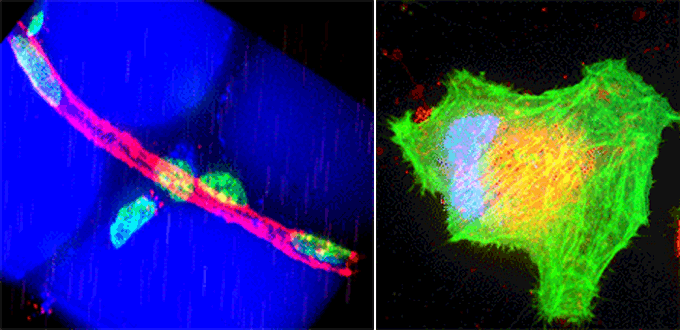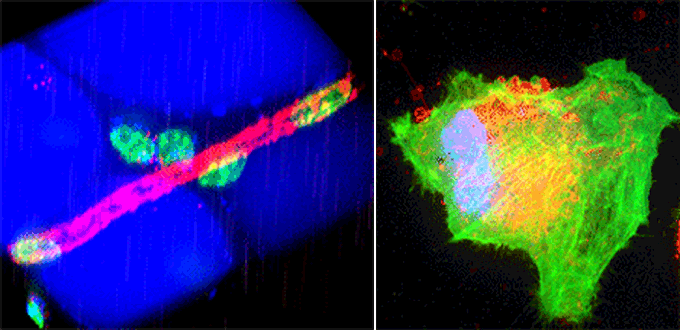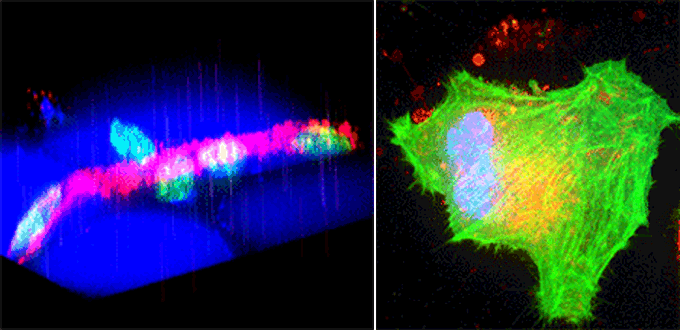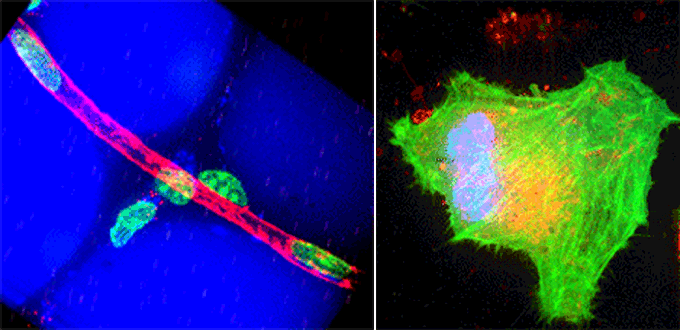
(左)マウスの脂肪組織中の血管。赤色が血管、青色が脂肪細胞、緑色が細胞の核を表している。撮影した画像から細胞の三次元構造を再構成することが出来る。
(右)メカニカルストレスによる細胞内小胞の脱出多色タイムラプス撮像NIH3T3培養細胞。青色が細胞の核、緑色がアクチン、赤色が小胞を表している。
速さ2倍、明るさ2倍、さらに機能も大幅アップ
NEDOプロジェクトの成果で完成した共焦点スキャナユニット「CSU-X1」は、高速性と鮮明な画像により、ライブセルイメージングに最適なツールとして高い評価を得ています。たとえば、それまで観察が困難だった脳内のニューロンの速い動きや生きた動物の赤血球の流れを捉えるなど、次々とその応用分野も広がっています。
CSU-X1は、CSU-10に比べて、速さは2倍、つまり、より高速でスキャンができます。約1,000本のレーザービームを同時に試料に照射して、しかも高速でビームを動かすため、1枚の画像を2,000分の1秒で得ることができます。
明るさが飛躍的に増したのは、光の利用率がCSU-10の2倍になったためです。その分、低出力のレーザーも使え、汎用性が高まります。CSU-X1は1000本のレーザビームを使うことで、1本当たりの照射強さを減らし、細胞の動きをとらえるとともに、細胞へのダメージを抑えることのできる機能も備えています。
また、複数の蛍光を2種類のカメラを切り替えて同時に撮影できるため、単色の画像からマルチカラーになりました。これを顕微鏡や超高感度のカメラと組み合わせることで、細胞内の分子の動きを三次元でリアルタイムに捉えることができるようになったのです。その成果として、長年謎とされてきたゴルジ体の輸送システムの解明などにもつながりました。この2色の同時撮影機能は、NEDOプロジェクトの成果を応用したものです。
画像ご提供:
理化学研究所脳科学総合研究センター 宮脇敦史先生
北海道大学電子科学研究所 永井健治先生
なお、本データはNEDOプロジェクト内のものではありません。

顕微鏡と接続した共焦点レーザースキャナCSU-X1

共焦点レーザースキャナCSU-X1ユニット単体
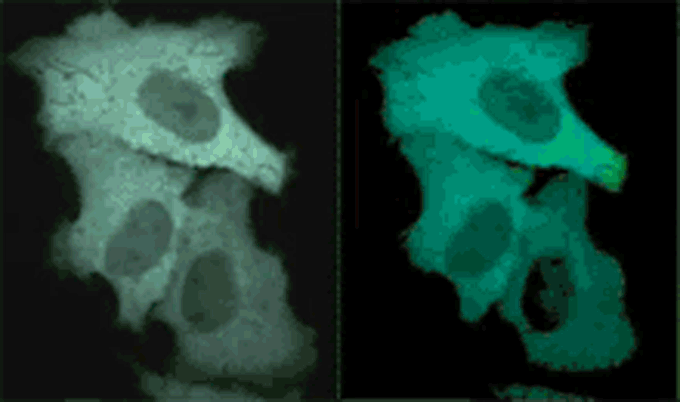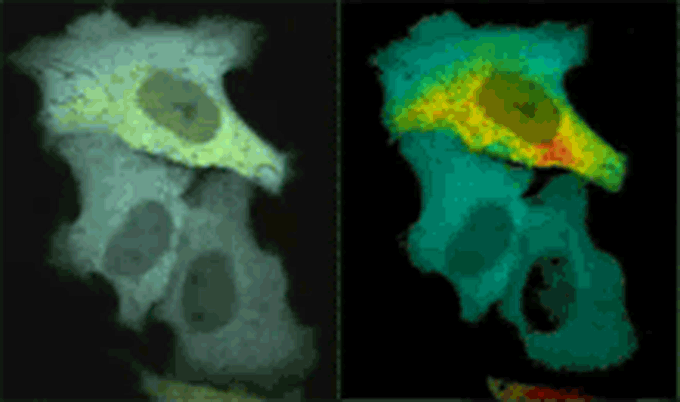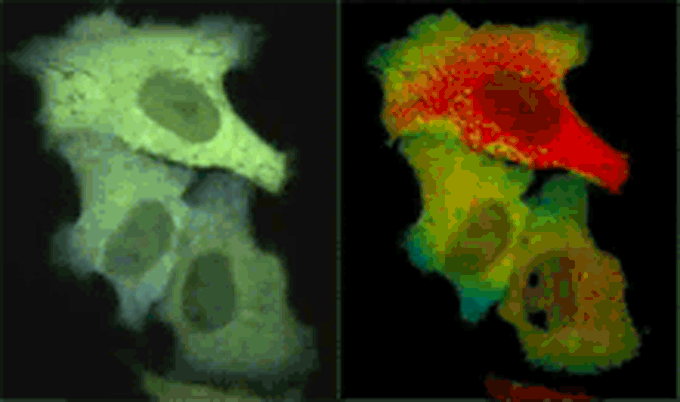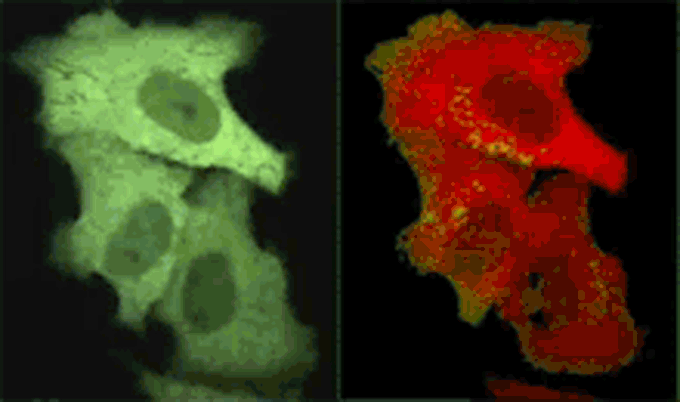
Yellow Cameleonを発現したHeLa細胞におけるヒスタミン刺激で発生したCa2+変化を共焦点リアルカラー画像とレシオ画像(擬似カラー)で示している。ビデオレート(30Hz)でCFPとYFPを同時撮影し、FRETによってCFPの蛍光が減衰し、YFPの蛍光が上昇する様子をリアルタイム観察。
細胞の動きを捉えた
NEDOプロジェクトでは、横河電機の共焦点レーザースキャナをNHK技研や日立国際電気などと共同開発した共焦点レーザー顕微鏡や超高感度で高速なHARPカメラと組み合わせて、0.01秒間隔で連続観察ができるシステムをつくりました。このシステムは100万画素ハイビジョンの解像度を持ち、まるで、電子顕微鏡の画像が動いたみたいだという感想がきかれるほどでした。
細胞生物学が専門の理化学研究所の中野明彦主任研究員らは、このシステムでライブイメージングを行い、ゴルジ体のタンパク質輸送メカニズムを立証しました。ゴルジ体は、細胞の内部にある様々な小器官のひとつで、小胞体でつくられたタンパク質を目的の小器官へと運ぶ役割をしています。
ゴルジ体の中をタンパク質がどう運ばれていくかは、長い間謎になっていて、研究者の間でも長らく論争が続いていました。中野主任研究員らが、赤と緑の蛍光タンパク質で標識した酵母をライブイメージングし、ゴルジ体の動きを実際に見ることで、この謎が解決しました。生物学の教科書を書き換えるほどの大発見です。
画像ご提供:
理化学研究所基幹研究所中野生体膜研究室
東京大学大学院理学系研究科 中野明彦先生
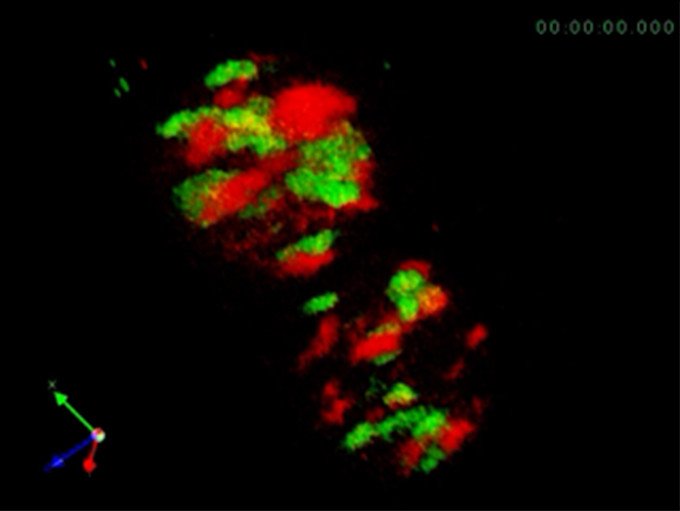
NEDOプロジェクトで開発したプロトタイプ機で初めて捉えた酵母細胞ゴルジ体画像。シス槽をmRFP、トランス槽をGFPで標識。
プロジェクトの突破口
BREAKTHROUGH
スキャンを高速化したニポウディスク方式の採用
横河電機の開発した共焦点レーザースキャナにおけるスキャンの高速化は、ニポウディスク式の採用により実現しました。これは、1884年にPaul Nipkowが開発した原理を応用したものです。
従来の共焦点レーザー顕微鏡で使われているガルバノミラー式は、レーザービームを試料上の1点に集光し、このビームを1点ずつスキャンします。この方式では、ノイズの少ない高解像度の画像が得られますが、スキャンに時間がかかってしまうため細胞内の動きを捉えることは困難でした。
そこで、横河電機ではスキャンを高速化するため、ニポウディスク方式を採用しました。ニポウディスクは、外側かららせん状にピンホールが開いていて、回転する円盤です。光を円盤にあて、ニポウディスクを回転させると面全体をスキャンできます。一度に1,000本ものビームを試料にあてることができるので、単純計算でも従来のガルバノミラー式より1,000倍もの速度になります。しかも、この回転を高速化させ、1秒間に1,000フレームのスキャンが可能になりました。さらに、現在のCSU-X1では、1秒間2,000フレームまでスキャンできる性能まで向上しています。
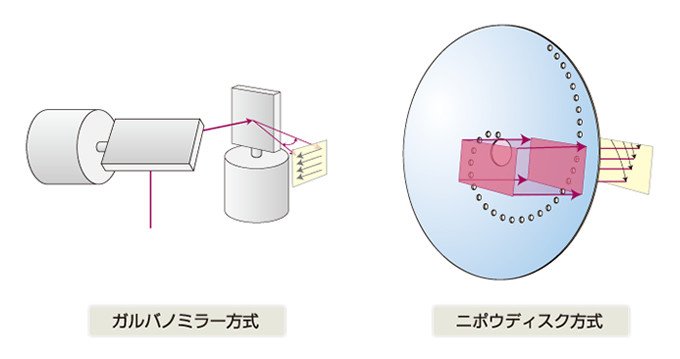
図2 共焦点顕微鏡の各種走査方式
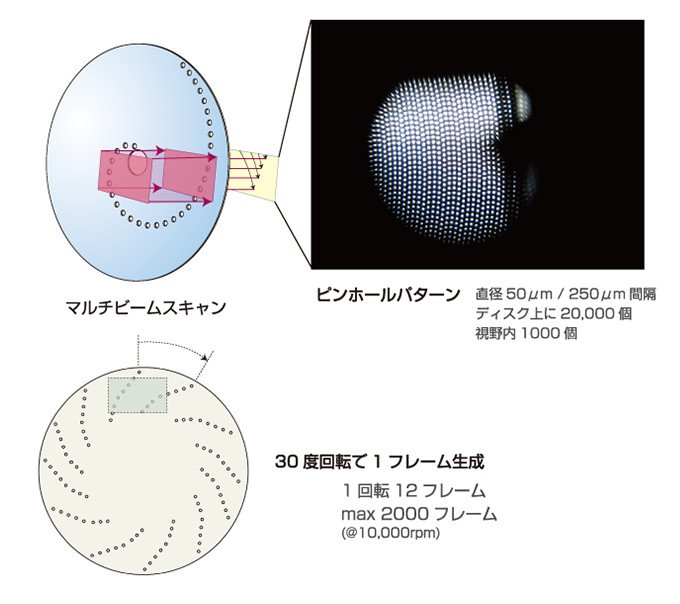
図3 ニポウディスクによるマルチビームスキャンの仕組みとピンホールディスク
マイクロレンズで画像を捉える明るさが可能に
ニポウディスクにより、スキャンの高速化はできるものの、光の利用効率が非常に低いものでした。ピンホールのところしか光が通らないからです。このため、画像は見えないほど暗いものばかりでした。横河電機では試行錯誤の末、マイクロレンズを使うことを考え出しました。ピンホール1個につき、ひとつのマイクロレンズをつけるのです。そうすれば、ほとんどの光を集めることができ、ノイズも減り、明るい画像を得ました。
このように、もう1枚のディスクを使い、ピンホールと同じ位置にマイクロレンズをつけ、2枚のディスクを上下にとりつけました(図4参照)。景虹之ライフサイエンスセンター開発グループ長は「ディスクには、直径50μmのピンホールが2万個あいています。もう一枚のディスクには2万個のマイクロレンズがあります。この穴を精密にあけることや、マイクロレンズをばらつきなく正確に作るのに苦労しました。さらに、ピンホールとレンズ位置を調整するのには、大変苦労しました。この軸が少しでもずれると、画像にならないのです。試作を繰り返し、うまくいくまでには5年もかかりました」と当時を振り返ります。
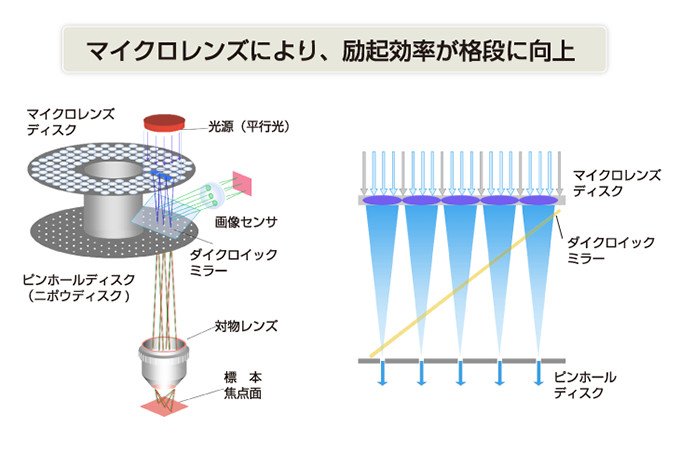
図4 マイクロレンズ付ニポウディスク方式
より明るく!より速く!
NEDOプロジェクトにおける共焦点レーザースキャナCSU-X1の開発では、さらに様々な技術が新たに生まれました。
鮮明な画像を得るためには、より明るくする必要があります。そのために生まれたのが励起光の効率をあげる技術です。従来のレーザー光は、明るさにムラがありました。山のような形に光が分布しているためで、その裾野の部分にあるかなりの量の光を無駄にしていました。そこで、何枚ものレンズを積み重ねることによって、広がった光を中心部に集め、ビームの形を変えることで、励起光の効率が従来の2倍になり、ノイズ光も3分の1に減らすことができました。
また、スキャン速度をあげるために、ニポウディスクの回転を高速化させました。モーターのバランスをとることで、振動は低く抑えながらも高速回転が可能になり、ディスク回転数は1分間に1万回となりました。高速化の技術は画像を切り替えるフィルターの回転にも活かされ、三次元画像やマルチカラーの観察が実現しました。こうした技術の積み重ねが、ゴルジ体の機能の発見につながったのです。
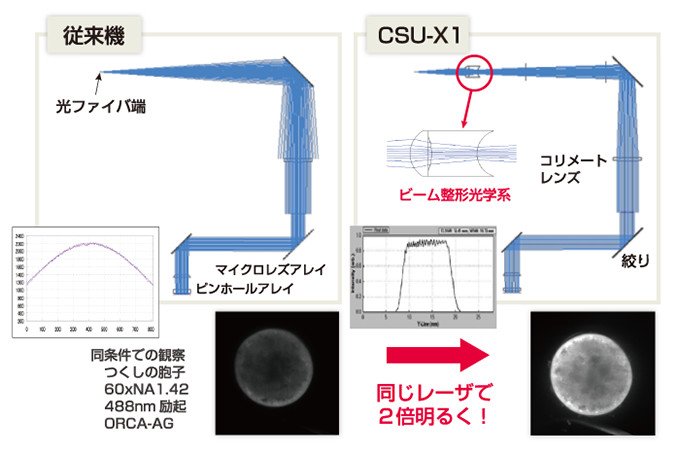
図5 励起効率の改善
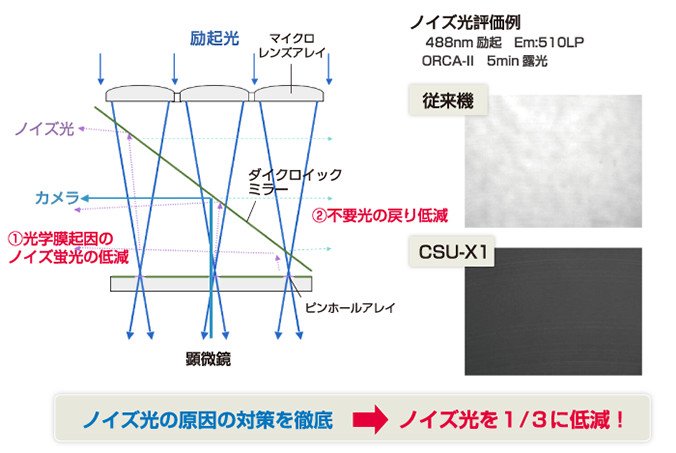
図6 ノイズ光の低減
開発のいま、そして未来
FOR THE FUTURE
ハイスループットへ
横河電機では、NEDOプロジェクトで開発した共焦点レーザースキャナをもっと広く色々な目的で利用してもらおうと、新製品の開発に取り組み続けています。
2009年3月に発表した「Cell Voyager CV6000」は、創薬への応用に特化したものです。細胞に候補化合物を与え、細胞の変化を画像処理により数値化し、薬効や副作用を試験する装置で、難しい操作をすることなく、大量のスクリーニングを行えるように工夫されています。
共焦点レーザースキャナを搭載し、1分間に96サンプルの3色撮影を行うことができるほか、4種類のレーザーと三つのカメラを使い、複数の色を同時に観察することもできます。さらに、共焦点画像ばかりでなく、位相差や落射蛍光画像などにも切り替えられるなどの特徴もあります。
「いかにハイスループットにするか、装置を安定して動かすかが課題でしたが、NEDOプロジェクトでたくさんの知見を蓄積できたので、比較的順調に開発できました」と景さん。CV6000は、5年間のNEDOプロジェクト後の2年間の継続研究期間に開発されました。
横河電機ではプロジェクトを通して、取得した特許を製品に適用しています。CV6000のように、成果は次の製品へと活かされています。2009年末には、CV6000を小型化した「CV1000」も発表され、生きた細胞の観察がさらに手軽にできるようになりました。

Cell Voyager CV6000

CV6000の試料搬入トレイ

Cell Voyager CV1000
ニーズとシーズがうまく合致した
横河電機がNEDOプロジェクトに参加した2003年は、ヒトゲノムの解析も終わり、ポストゲノムの時代といわれた頃でした。生命を分子レベルでなく、細胞や組織の動きで捉えたいとイメージングの研究がちょうど始まったころでもあります。「タイミングがよかった」と景さんが語るように、共焦点レーザースキャナの開発というシーズが時代のニーズと合致していました。後にノーベル化学賞を受賞したGFPをはじめ、標識のための蛍光タンパク質も次々に開発され、プロジェクトで出来たツールを生かすことが出来るようになっていきました。
プロジェクトのメンバーとして、理化学研究所の中野主任研究員らも参加していました。まさにユーザーである研究者と一体となった開発だったのです。ユーザーと対等にディスカッションをすることで、要望に合わせてコンポーネントも次々と変えていきました。「顕微鏡で細胞が見えたよろこびも共有することができました」と語るのは、ライフサイエンスセンター開発グループ開発5チームの蛭川英男マネージャーです。ユーザーの成果に直結した開発だったので、サイエンスに貢献している実感が湧いたと話します。プロジェクトを進めていくうち、理化学研究所やNHK技研などプロジェクトのメンバーや推進委員との交流も広がりました。
景さんは、「プロジェクトの期間は5年間。この5年の間に開発した装置を研究者に使ってもらわないと成果になりません。しかも、バイオテクノロジーの進化はとても速いので、ぐずぐずしていられないという思いもありました。NEDOの加速資金も受けることができ、3年目には、製品化にこぎつけることができました」と当時を振り返ります。
ライブイメージングによって、明らかになる様々な生命現象。共焦点スキャナは、生命科学の発展に貢献するツールとして、ますます価値が高まっていくと考えられます。(2011年2月取材)
注:CSUおよびCell Voyagerは横河電機株式会社の登録商標です。
画像ご提供:
理化学研究所 発生・再生科学総合研究センター
ゲノム・リプログラミング研究チーム(若山照彦研究室)
(現:大阪大学微生物病研究所) 山縣一夫先生
なお、本データはNEDOプロジェクト内のものではありません。
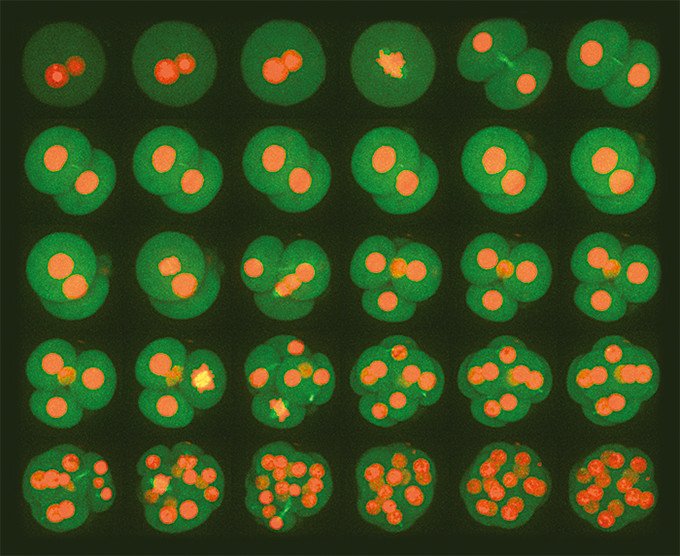
CV1000を使用して取得した、マウスの初期胚発生の長時間(60時間)多次元イメージング
開発者の横顔
FACE
異分野へ、ユーザーの意見を聴きながら取り組む
生物の研究の苦労を実感
景虹之グループ長は、1992年に横河電機に入社。半導体の製造装置や工場の監視カメラの開発に携わってきました。NEDOプロジェクトには最初から最後まで参加し、終了後も共焦点レーザースキャナや創薬支援装置の開発を続けています。「もともと光が得意。自分の技術や経験が活かせるので、『やってやるぞ』という気持ちでした」と当時の意気込みを語ります。プロジェクトでは、研究者とともに毎日、顕微鏡で細胞を見続けて、ついにゴルジ体の動く瞬間の画像を撮ることができました。「その喜びを研究者と分かち合いながらも、生物の研究には大変な苦労があることを実感しました」。

横河電機株式会社
景さん
ユーザーのニーズをどう取り込むのかが重要
蛭川英男マネージャーは、1981年に入社後、光ディスクや液晶パネルの検査装置の開発をしてきました。NEDOプロジェクトでは、三波長分光器を開発しました。プロジェクト終了後、共焦点レーザスキャナCSU-X1の開発を主導しました。またユーザーに対する装置のセットアップやサポートを担当しました。ユーザーから、装置に対する要望を聴くことが多く、「製品開発では、ユーザーのニーズを取り込むのが重要だと強く感じました」と蛭川さん。「NEDOプロジェクトでは、ユーザーである研究者が一緒だったからこそ、普段できない大胆な発想で開発を進めることができました。このような機会が増えるといいと思います」。

横河電機株式会社
蛭川さん
 なるほど基礎知識
なるほど基礎知識
光学顕微鏡と電子顕微鏡
顕微鏡は、接眼レンズと対物レンズからなります。まず、対物レンズで微小な物体を拡大して実像をつくり、さらにその実像を接眼レンズで拡大し、その虚像を観察します。
光学顕微鏡で見える像は、ふたつの光からつくられます。ひとつは、「直接光」とよばれる像の背景に広がる光で、試料の影響を受けません。もうひとつは、「回折光」とよばれる試料の情報を持つ光です。この光は、試料により回折されます。これらの光が像を結ぶ面で、強めあったり、弱めあったりして像をつくります。
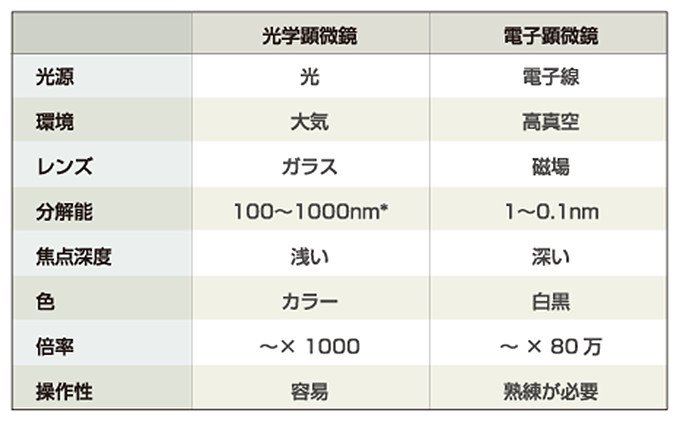
表1 光学顕微鏡と電子顕微鏡の特徴
光学顕微鏡には、一般的な顕微鏡以外にも、位相差顕微鏡、微分干渉顕微鏡、蛍光顕微鏡、レーザー顕微鏡などの種類があり、目的に応じて使い分けられています。
しかし、細胞の内部構造などより細かいものを見るためには、さらに解像度を大きくする必要があります。解像度とは、異なる2点間の識別能すなわち分解能として測ることができます。これは、観察に使う光の波長に比例し、対物レンズの開口数に反比例します。そこで、波長の短い光を開口数の大きな対物レンズで観察すれば、解像度を大きくすることができます。ところが、光の波長はせいぜい200nmまでですから、光による観察には限界があります。
そこで、光に比べて波長がはるかに短い電子線を光の代わりに使ったのが電子顕微鏡です。ヒトの肉眼での分解能は約0.1mm、光学顕微鏡は約0.2μmですが、電子顕微鏡では約0.2nm。光学顕微鏡の千倍もの解像度の電子顕微鏡を使えば、詳細な細胞の内部構造まで見ることができます。ただし、電子線を使うため、細胞を生きたまま観察することはできません。
※Abbeの回折理論により、可視光領域の分解能の限界は200nm程度とされてきましたが、最近はその限界を超える顕微鏡が次々と開発されています。
生きた細胞の観察を可能にした蛍光標識
細胞はほぼ透明ですから、いくら顕微鏡で拡大しても観察が難しいものです。そこで、特徴を分かりやすくするために、細胞を色素で染めて観察することがあります。しかし、染めると細胞は死んでしまいます。位相差顕微鏡では、像の明暗のコントラストで試料を観察します。透明な試料を染色せずに見ることができるので、生きたままの細胞を観察できます。
近年、蛍光標識による細胞観察がよく行われています。蛍光は感度が高く、明るさや波長の違いも検出できるので、蛍光を使うと、細胞内部の分子まで観察できます。蛍光観察には、蛍光物質を励起させる必要があるため、蛍光顕微鏡やレーザー顕微鏡を使います。
蛍光標識に使われる物質としてよく知られるのは、2008年にノーベル賞を受賞した下村脩博士が発見したGFP(緑色蛍光タンパク質)です。GFPの遺伝子を細胞に導入すれば、生きた細胞の中でも目的のタンパク質を緑色に光らせることができます。この発見以後、赤や黄色などさまざまな色の蛍光物質が発見されています。これら蛍光物質の利用によって、これまで見られなかった生きた細胞内の現象を蛍光で観察できるようになりました。
お読みいただきありがとうございました。
ぜひともアンケートにお答えいただき、
お読みいただいた感想をお聞かせください。
いただいた感想は、
今後の連載の参考とさせていただきます。